L’étude de la communication entre les cellules résidentes osseuses et les cellules du système immunitaire revêt un intérêt majeur dans la compréhension des mécanismes étiopathogéniques des maladies à tropisme osseux. Une meilleure compréhension des dérégulations de l’homéostasie tissulaire favorisera de nouvelles approches diagnostiques ou thérapeutiques et permettra d’optimiser l’intégration de biomatériaux chez des patients présentant des pathologies sous-jacentes. Les communications intercellulaires seront ainsi abordées via l’étude de maladies rares à tropisme osseux (mucoviscidose, dysplasie fibreuse osseuse, ostéosarcome…) ou de comorbidités (infections,…), en utilisant à la fois des approches fondamentales et cliniques.
- Pathologie osseuse dans la mucoviscidose
- Caractérisation phénotypique de cultures primaires d’ostéoblastes humains mandibulaires issues de patients présentant une dysplasie fibreuse des os
- Evaluation de la présence, et caractérisation de neutrophiles associés aux tumeurs dans les sarcomes osseux
- Ostéonécrose des Mâchoires induite par les biphosphonates (POM)
- Prévalence de la maladie parodontale chez les patients adultes atteints par la mucoviscidose pris en charge au CHU de Reims: Etude Pilote
Pathologie osseuse dans la mucoviscidose (MucOstéoporose):
Responsable du projet : Dr Frédéric VELARD
FINANCEMENT :
Vaincre la mucoviscidose – Région Grand Est – Grand Reims
DOMAINES D’APPLICATION :
Maladies Rares Osseuses
PUBLICATIONS :
Les publications antérieures de l’équipe sur ce thème sont accessibles ici
COLLABORATIONS :
Filière Santé Maladie Rares OSCAR / CHU de Reims / Hôpital Necker INSERM U 1151, Paris / Hôpital Cochin, Paris / Hôpital Européen Georges Pompidou, Paris / INSERM U 938, Paris / INRA UMR USP, Tours / INSERM U 1100, UFR, Tours / LASMIS, FRE CNRS 2848, UTT Troyes / LEM3, UMR CNRS 7239, UL, Metz / MABLab, ULR4490, ULCO / Center for Cystic Fibrosis & Airways Disease Research, Emory University, Atlanta, USA / The Saban Research Institute, University of South California, Los Angeles, USA / Ludwig-Maximilians-Universität, Munchen, Germany / Universita’ Degli Studi Di Milano, Italy / National University Of Ireland, Cork, Ireland / Lundquist Institute at UCLA & Chilren’s Hospital Los Angeles, CA, United-States/Vertex Pharmaceuticals/VG2D Pharma.
THEMATIQUE :
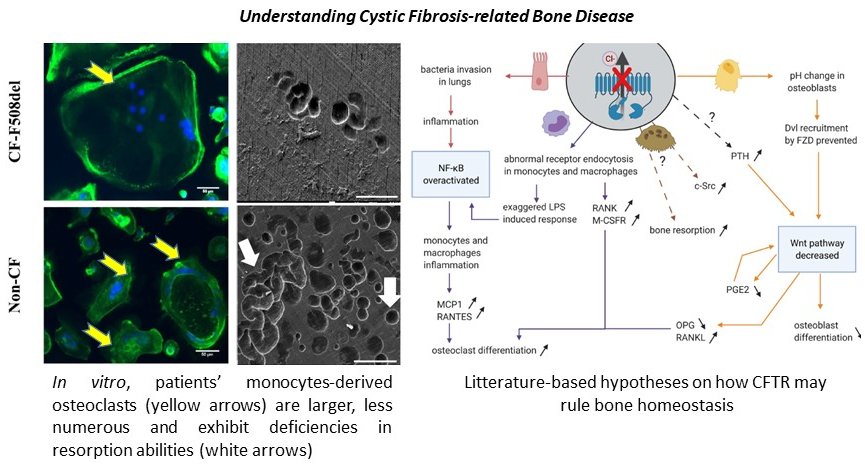
L’homéostasie tissulaire est assurée par un couplage des activités des cellules ostéoformatrices et ostéorésorbantes. Toute perturbation de cet équilibre mène irrémédiablement à une perte osseuse.
Chez les patients souffrant de mucoviscidose (CF), un risque de fractures vertébrales et costales majoré a été rapporté et lié à une ostéoporose précoce due à des mutations dans le gène codant le canal chlorure CFTR. Nos précédents travaux au laboratoire ont démontré que la déficience du canal CFTR dans les ostéoblastes issus de patients CF in vitro aboutit à une dérégulation des fonctions biologiques de ces cellules. L’impact de la dysfonction de CFTR dans les ostéoclastes aboutit également à une activité cellulaire réduite et, in fine, à une homéostasie osseuse perturbée. Chez le patient possédant un CFTR dysfonctionnel, une meilleure compréhension du remodelage osseux passe par une étude et une caractérisation plus complète des propriétés des différentes cellules abritées par le tissu osseux.
Plusieurs programmes de recherche translationnels, appuyés par l’étude clinique MucOs NCT04877223, se sont ainsi développés : « Formation et activité fonctionnelle des ostéoclastes : implication dans la perte osseuse chez les patients atteints de mucoviscidose et étude des effets de correcteurs de CFTR », « Nouvelles opportunités d’étude des comorbidités dans la mucoviscidose grâce aux cellules souches pluripotentes induites » et « Etude de l’impact du défaut de fonction de CFTR dans le développement de l’ostéoporose ». Ils visent à mieux comprendre la communication entre les ostéoblastes et les ostéoclastes, mais également les adipocytes médullaires et les ostéocytes. Ces travaux sont réalisés au travers de plusieurs approches :
1) L’impact du défaut d’activité CFTR sur les précurseurs circulants et le phénotype ostéoclastique
2) La détermination de nouveaux biomarqueurs et de nouveaux acteurs cellulaires dans la pathologie osseuse liée à la mucoviscidose
3) L’impact du défaut d’activité CFTR sur la différenciation des cellules souches
4) L’impact du défaut d’activité CFTR sur l’architecture osseuse et la validation de nouveaux composés à visée thérapeutique
Parallèlement à ces études sur cellules primaires humaines nous caractérisons également le phénotype osseux de modèles porcins CFTR KO et murins F508del / G542X afin de comprendre l’impact du défaut de flux chlorure sur le développement et l’architecture osseuse au cours du vieillissement.
Caractérisation phénotypique de cultures primaires d’ostéoblastes humains mandibulaires issues de patients présentant une dysplasie fibreuse des os:
Responsable du projet : Dr Johan SERGHERAERT
FINANCEMENT :
DOMAINES D’APPLICATION :
Maladies rares osseuses
COLLABORATIONS :
CHU de Reims / CHU de Bordeaux / CHU de Strasbourg / LYOS, INSERM UMR 1033, Lyon
THEMATIQUE :
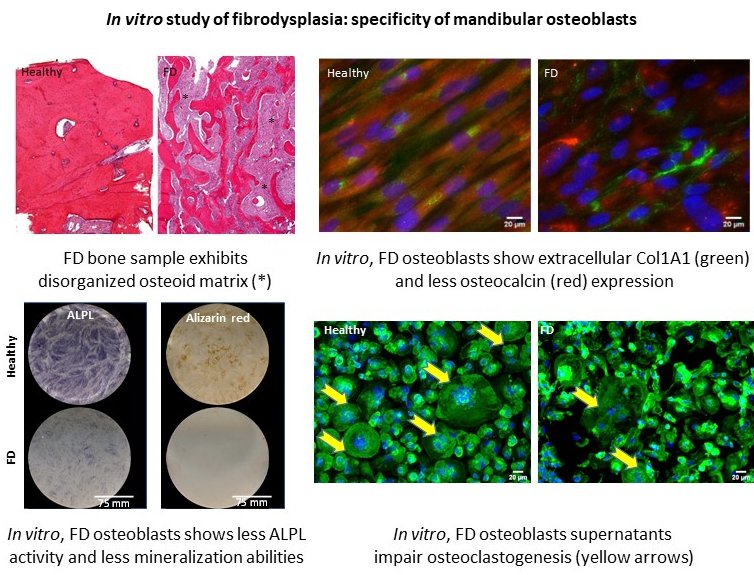
La Dysplasie Fibreuse des os (FD) est une pathologie génétique congénitale mosaïque rare, caractérisée par le remplacement progressif du tissu osseux sain par une matrice ostéoïde non minéralisée. Ces atteintes osseuses, principalement décrites sur le squelette appendiculaire, entrainent principalement des déformations desquelles résultent des douleurs, des incapacités fonctionnelles, des troubles sensorielles et/sensitifs ou encore des préjudices esthétiques. A ce jour, aucune thérapie étiologique n’est proposée pour les patients atteints de FD dont la prise en charge est exclusivement symptomatique comprenant des traitements pharmacologiques à visée antalgique et des chirurgies résectrices pour corriger les déformations. Dans la sphère oro-faciale, la pathogénie de ces lésions est peu décrite, si bien que leur prise en charge clinique reste principalement symptomatique.
La FD résulte de mutations du gène GNAS qui induisent une augmentation de la concentration intracellulaire d’AMPc. Des études in vitro et in vivo ont mis en évidence un accroissement des capacités prolifératives des cellules mutées ainsi qu’une altération de leur capacité d’engagement et de maturation ostéoblastique. Ce défaut de différenciation ostéoblastique engendre alors la synthèse d’une matrice fibreuse immature.
Les principes actifs aujourd’hui prescrits aux patients comprennent des bisphosphonates dont les résultats cliniques sont variables dans la prise en charge de la douleur.
Les approches développées autour de ce thème comprennent donc :
- Une meilleure caractérisation des différences phénotypiques entre les cellules osseuses dysplasiques issues de la sphère oro-faciale comparativement aux cellules du squelette appendiculaire afin de pouvoir envisager des prises en charge dédiées.
- La proposition d’une nouvelle approche thérapeutique novatrice dans la prise en charge de la dysplasie fibreuse des os ciblant des médiateurs solubles susceptibles d’aggraver la progression fibrotique
Evaluation de la présence, et caractérisation de neutrophiles associés aux tumeurs dans les sarcomes osseux:
Responsable du projet : Dr Frédéric VELARD
FINANCEMENT :
SFR Cap-Santé ; Cancéropôle Grand Est
DOMAINES D’APPLICATION :
Cancérologie
COLLABORATIONS :
Institut Godinot / CHU de Reims / ICMR, UMR CNRS 7312 / IPHC UMR CNRS 7178
THEMATIQUE :
Les sarcomes osseux (chondrosarcomes et ostéosarcomes) présentent un taux de métastases très élevé en dépit d’approches thérapeutiques agressives. Il y a donc un besoin pressant de trouver de nouvelles cibles thérapeutiques pour renforcer l’efficacité des traitements administrés aux patients. Les TANs («Tumor Associated Neutrophils») pourraient être l’une d’entre elles. Identifiées dans de nombreux carcinomes, ces cellules au profil anti- ou pro-tumoral n’ont à ce jour pas été décrites dans les sarcomes osseux. C’est pourquoi ce projet TAN-OS (Evaluation de la présence, et caractérisation, de neutrophiles associés aux tumeurs dans les sarcomes osseux) propose de :
- Rechercher au sein d’une banque (tumorothèque) et de prélèvement frais humains la présence de TANs au moyen d’approches histologiques et immunohistochimiques,
- Développer en parallèle un modèle d’étude in vitro visant à comprendre la capacité de cellules de lignées sarcomateuses humaines à induire l’orientation du phénotype N1 ou N2 de neutrophiles primaires humains.
- Proposer de nouvelles approches théranostiques pour accélérer la prise en charge des patients et optimiser l’arsenal thérapeutique actuel.
Les résultats de ce programme translationnel, appuyé par l’étude TAN-OS NCT04867421, devront permettre, pour la première fois, de statuer quant à la présence et au phénotype des TANs dans le microenvironnement tumoral des sarcomes osseux et de proposer un modèle original de caractérisation du phénotype des neutrophiles, ouvrant la voie au criblage de nouvelles molécules thérapeutiques pour traiter les sarcomes osseux.
Ostéonécrose des Mâchoires induite par les biphosphonates
Responsable du projet : Pr Cédric MAUPRIVEZ
FINANCEMENT :
DOMAINES D’APPLICATION :
COLLABORATIONS :
THEMATIQUE :
Partie En Construction
Prévalence de la maladie parodontale chez les patients adultes atteints par la mucoviscidose pris en charge au CHU de Reims: Etude Pilote
Responsable du projet : Dr Marie-Laure JOURDAIN
FINANCEMENT :
SFR Cap-Santé ; CHU de Reims ; Institut Godinot ; URCA
DOMAINES D’APPLICATION :
Maladies Rares
Parodontologie
COLLABORATIONS :
Université Paris Cité Santé, UFR Odontologie
THEMATIQUE :
La mucoviscidose (CF : Cystic Fibrosis) est une maladie génétique qui touche plus de 7500 patients en France. Ces dernières années l’espérance de vie des patients CF a formidablement augmenté puisqu’en 2021, 61,7% d’entre eux avait atteint l’âge adulte. Ces données encourageantes sont grandement liées à l’avènement des thérapies modulatrices de CFTR qui ciblent les dysfonctions liées à certaines mutations et visent donc le mécanisme causal de la maladie.
Une grande diversité d’expression clinique est observée que ce soit pour l’âge d’apparition des premiers symptômes que pour la sévérité de l’évolution et de l’atteinte respiratoire qui conditionne encore aujourd’hui le pronostic vital dans la majorité des cas. Bien que les manifestations cliniques de la mucoviscidose s’expriment principalement au niveau des voies respiratoires et du tube digestif, cette pathologie se révèle bel et bien multi-organes et s’accompagne de comorbidités parfois sévères endocriniennes (diabète), osseuses et psychologiques dont la prévalence augmente avec l’âge impactant considérablement la qualité de vie des patients CF.
Malgré l’évolution démographique, à ce jour, les données de la littérature scientifique concernant l’impact de la mucoviscidose et ses traitements sur la cavité orale et notamment sur les tissus parodontaux des patients CF adultes sont quasi inexistantes.
Pourtant la proximité anatomique évidente entre la cavité orale qui forme un véritable réservoir de micro-organismes et l’arbre respiratoire laisse à penser que les pathogènes oraux sont susceptibles de se disséminer au niveau pulmonaire. En effet, la cavité buccale présente l’un des microbiotes les plus riches du corps formant un véritable réservoir de micro-organismes parmi lesquels on retrouve plus de 700 espèces bactériennes (Paster et al. 2006; Aas et al. 2005). Ces bactéries ont la capacité de s’organiser en biofilm notamment au niveau de la surface dentaire et à l’interface avec les tissus parodontaux. L’apparition d’une dysbiose au sein du biofilm dentaire explique en partie la survenue des maladies parodontales (Hajishengallis, et al. 2012). En réponse à cette dysbiose, les tissus parodontaux développent une réponse immuno-inflammatoire exacerbée aboutissant in fine à la destruction du système d’attache de la dent et à la formation de niches biologiques de pathogènes nommées poches parodontales (Meyle et Chapple 2015). Des études menées chez des patients CF, ont pu mettre en évidence que la cavité buccale (dos de la langue, salive, plaque dentaire sous-gingivale) formait un site protégé pour des pathogènes respiratoires et notamment pour P. aeruginosa principale bactérie impliquée dans l’infection respiratoire des patients CF (Bensel et al. 2010; Souto, Silva-Boghossian, et Colombo 2014) La survenue des maladies parodontales est également influencée par l’exposition à deux facteurs de risque majeurs le tabagisme et le diabète.
Le dépistage précoce et le traitement des maladies parodontales ont donc un intérêt primordial chez les patients présentant un risque accru aux infections respiratoires tels que les patients CF. Dans ce cadre la mise en place d’une consultation dentaire annuelle au cours des entretiens trimestriels de suivi des patients CF peuvent apporter une réponse en termes de dépistage et de traitement précoce de ces pathologies.
De nombreuses pathologies à composante infectieuse et inflammatoire, dont font partie les parodontites ou la mucoviscidose, impliquent des mécanismes immunitaires souvent dérégulés, parmi lesquels la production de peptides antimicrobiens (AMP) (Guaní-Guerra et al. 2010; Guentsch et al. 2012; Jourdain et al. 2018; 2019). Ces peptides présentent des propriétés antibactériennes et immuno-modulatrices et forment une barrière de défense précoce de l’organisme contre les infections, que ce soit dans les tissus pulmonaires ou parodontaux.
Ce programme de recherche permettra donc l’acquisition de données cliniques et biologiques sur les pathologies parodontales dont pourraient souffrir les patients CF adultes. Par sa transversalité, ce travail permettra d’obtenir également des données plus fondamentales sur un l’impact de la dysfonction de CFTR à la fois sur l’immunité locale et l’expression des AMPs.
Le développement spectaculaire des biotechnologies et leur élargissement à de nombreuses branches d’activités ont entraîné l’émergence de nouveaux domaines de recherche et l’introduction de nouveaux concepts susceptibles de pallier le manque d’organes. C’est ainsi, qu’au cours de ces deux dernières décennies, est apparue une nouvelle discipline basée sur les concepts du génie biologique, la « Médecine Régénératrice ». Cette discipline permet de concevoir au laboratoire un tissu biologique fonctionnel apte à remplacer un organe défaillant. Axés sur la médecine régénératrice osseuse, les travaux de recherche revêtent un caractère pluridisciplinaire allant de la biologie cellulaire au travers de la culture et du suivi de la différenciation cellulaire, notamment celle des cellules souches, de la physicochimie et traitements de surfaces via les biomatériaux, de la biomécanique/mécanobiologie jusqu’à la validation chez l’animal.
- Elaboration des substrats phosphocalciques hybrides par pulvérisation et étude du comportement des cellules souches périnatales à leur contact
- Comportement des cellules souches d’origine humaines dans des matrices tridimensionnelles pour la médecine régénératrice
- Développement de biomatériaux polyvalents, ostéoinducteurs, poreux et biodégradables pour la régénération osseuse
- Impression 3D de matrices à partir de polymères à mémoire de forme
Elaboration des substrats phosphocalciques hybrides par pulvérisation et étude du comportement des cellules souches périnatales à leur contact
Responsable : Pr Halima KERDJOUDJ
FINANCEMENT : Soutien à la recherche odontologique-CONCEPT ; PEPS Mirabelle ; Fondation des Gueules Cassées
DOMAINES D’APPLICATION : Médecine Régénératrice
PUBLICATIONS: – Rammal H et al. Frontiers in Bioengineering and Biotechnology. 2019:7;257.
– Dubus M et al., Colloids and Surfaces B: Biointerfaces. 2019:181;671-679.
– Rammal H et al. Int J Mol Sci. 2018;19(11). pii: E3458.
– Rammal H et al. ACS Appl Mater Interfaces. 2017;9(14):12791-12801.
– Mechiche Alami S et al. Acta Biomater. 2017;49:575-589.
COLLABORATIONS : UMR CNRS 7564 (Laboratoire de Chimie Physique et Microbiologique pour l’Environnement) – UMR 7198 CNRS-Université de Lorraine (Institut Jean Lamour) – UPR22 CNRS ICS (Institut Charles Sadron) – INSERM UMRS-1121 (Biomatériaux-Bio-ingénierie)
THEMATIQUE :
Idéalement, les matériaux développés en ingénierie du tissu osseux doivent provenir de l’association d’une matrice minérale et d’une matrice organique. Dans cet axe, nous proposons d’utiliser le procédé de pulvérisation simultanée de composés en interaction pour l’élaboration de substrats hybrides phosphocalciques/polymères. Ainsi, la co-précipitation des substrats hybrides est obtenue à partir d’une solution saturée en sels de calcium supplémentée en polymères polycationiques et d’une solution saturée en sels de phosphates supplémentée en polymères polyanioniques. Les propriétés physiques des substrats pulvérisés telles que l’épaisseur, la rugosité et le module d’élasticité du substrat sont modulables en fonction du nombre de cycles de pulvérisation.
Les cellules souches périnatales exprimant le phénotype des cellules souches ont été cultivées sur les substrats phosphocalciques et phosphocalciques hybrides pulvérisés. Les résultats obtenus nous ont permis de mettre en évidence le caractère ostéo-inducteur des substrats pulvérisés. En effet, une différenciation des cellules souches périnatales en ostéoblastes-like, accompagnée d’une formation de nodules tridimensionnels (bone-like) a été observée en l’absence de milieu de culture ostéo-inducteur. Le suivi du comportement des cellules souches périnatales au cours du temps a permis d’identifier le rôle de la topographie de surface et de la mécano-transduction dans la différenciation ostéoblastique. L’incorporation des molécules organiques semble retarder le processus de minéralisation de la matrice extracellulaire.
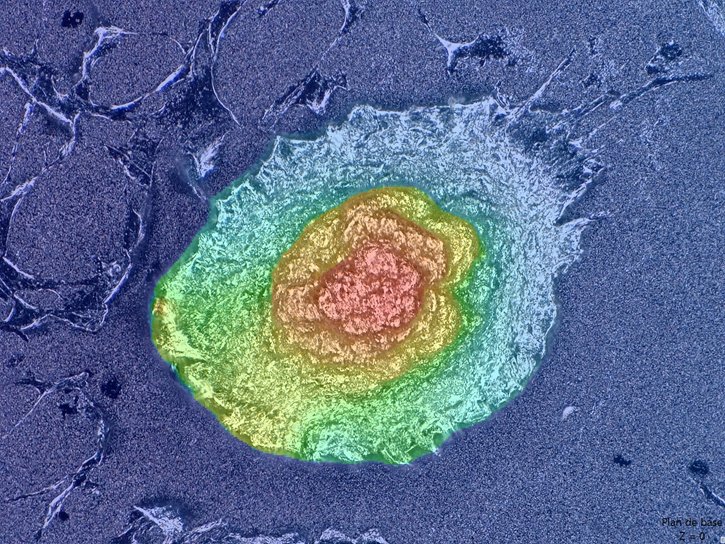
Formation de nodule osseux (bone-like) sur les matériaux phosphocalciques
Comportement des cellules souches d’origine humaines dans des matrices tridimensionnelles pour la médecine régénératrice
Responsable : Pr Halima KERDJOUDJ
FINANCEMENT : Fondation des Gueules Cassées, INTERREG-V France Wallonie Flandres ; Inter-carnot MICA / ICEEL ; Excellence Région Champagne-Ardenne
DOMAINES D’APPLICATION : Médecine Régénératrice
PUBLICATIONS : – Aubert L et al. Int J Mol Sci. 2017 Oct 21;18(10). pii: E2210.
– Lutzwei G et al., ACS Appl. Mater. Interface. 2019 doi: 10.1021/acsami.9b04625
COLLABORATIONS : –
CRITT- MDTS (Centre Régional d’innovation et de Transfert de Technologie : Matériaux, Dépôts et Traitements de Surfaces) de Charleville-Mézières – CRITT-JTFU (Centre Régional d’innovation et de Transfert de Technologie : Techniques Jet de Flux et Usinage) de Bar-le-Duc – CENtre du TEXtile BELge (CENTEXBEL) – Laboratory of polymeric and composite materials (UMONS) – LEM3, UMR CNRS 7239, Université de Lorraine – Université de Gand – Ecole Nationale Supérieure Mines-Télécom Lille Douai – Katholieke Universiteit Leuven
THEMATIQUE :
L’ingénierie tissulaire et la thérapie cellulaire représentent des domaines de recherche de la médecine régénératrice en plein essor avec l’espoir d’applications cliniques en thérapie cellulaire et tissulaire qu’elle suscite. Ce domaine pluridisciplinaire vise à développer de nouveaux tissus fonctionnels en associant des cellules souches régénératrices à une structure tridimensionnelle « textile » ou « mousse » supportant et guidant le développement tissulaire.
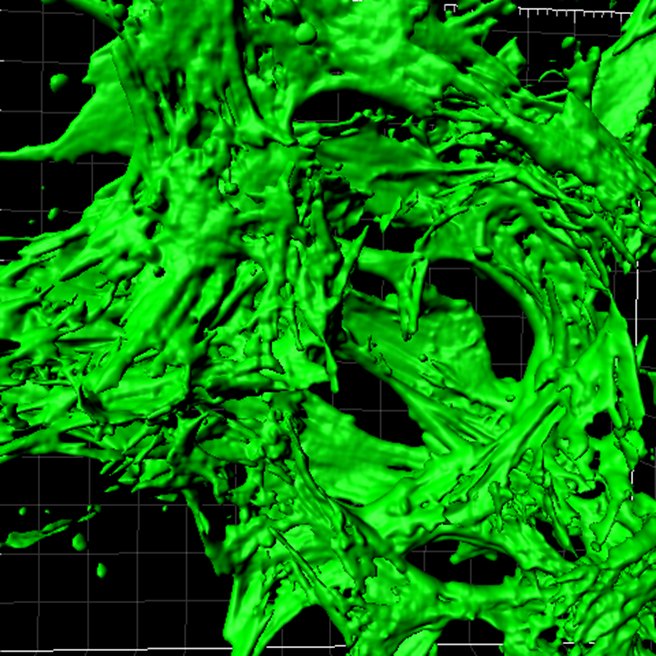
Cellules souches mésenchymateuses dans les mousses de collagène
PIM-structured multi-element doped calcium phosphates implants for large bone defects regeneration (PIMyBone)
Responsable du projet : Dr Frédéric VELARD
FINANCEMENT :
ANR, Institut Carnot MICA, Fondation des Gueules Cassées, Noraker
DOMAINES D’APPLICATION :
Biomatériaux, Régénération tissulaire osseuse
PUBLICATIONS :
Les publications antérieures de l’équipe sur ce thème sont accessibles ici
COLLABORATIONS :
CRITT-MDTS, Charleville-Mézières – EA 4695 LISM, URCA, Reims – SIGMA Clermont, UCA, Aubière – Mines Saint-Etienne, Saint-Etienne – URD-ABI, AgroParisTech
THEMATIQUE :
De nos jours, les difficultés rencontrées par les patients pour retrouver leur fonction articulaire suite à des interventions chirurgicales entraînent des durées d’hospitalisation étendues et un coût non négligeable pour la société. C’est pourquoi il est important de pouvoir contrôler efficacement la régénération osseuse pour que ces patients retrouvent au plus vite autonomie et capacités motrices.
En dépit d’avancées considérables dans la recherche de la structure idéale pour la régénération osseuse, aucun des biomatériaux actuels n’est totalement satisfaisant. Nous proposons de combiner des phosphates de calcium ostéoconducteurs avec des verres bioactifs ostéoinducteurs ou des céramiques dopées avec des éléments traces (Zinc, Strontium, Cuivre…), afin d’élaborer une structure à échelle de porosité multiple et présentant une dégradation graduelle (liée aux propriétés de solubilité intrinsèques des matériaux choisis) en vue de nous rapprocher au mieux du cahier des charges du biomatériau idéal. Afin de mettre en œuvre ce processus, nous nous appuierons sur la technologie d’injection des poudres (PIM) qui permet d’obtenir des pièces complexes en grande série, ce qui laisse entrevoir un transfert vers l’industrie facilité en cas de succès.
Ce projet de recherche appliquée vise donc à développer des matériaux à architecture optimisée pour la régénération des grands défauts osseux en utilisant des composites céramiques/céramiques dopées, offrant divers niveaux de bioactivité via des macro/microporosités et une solubilité contrôlée. Ces blocs « prêts à l’emploi » auront vocation à être utilisés simplement en les associant les uns aux autres afin de pouvoir être adaptables à toute taille et forme de comblement.
Le présent programme a pour vocation de :
1)- développer de nouveaux modes de production de structures hybrides aux propriétés physico-chimiques et mécaniques adaptées à la régénération d’un tissu osseux proche de l’os natif
2)- caractériser in vitro et in vivo la capacité de ces structures à accueillir et favoriser le développement des cellules osseuses mais également des cellules endothéliales, la problématique de la vascularisation des grands défauts osseux restant centrale en chirurgie osseuse, et à maîtriser les processus inflammatoires
Notre approche reposant sur les capacités ostéoconductrices et la forte bioactivité des matériaux choisis devrait permettre d’éviter le recours à la greffe autologue (utilisée en complément de biomatériaux pour faciliter leur intégration tissulaire) limitant ainsi douleur et morbidité pour les patients. De plus, l’utilisation, pour une partie de ces matériaux (céramiques phosphocalciques), d’ores et déjà autorisés par l’Agence Nationale de Sécurité du Médicament, permettra de pouvoir proposer rapidement des applications cliniques de notre produit. L’utilisation de matériaux dopés en éléments traces devrait nous permettre d’accéder de surcroît à des propriétés biologiques inédites et d’intérêt pour la régénération osseuse (contrôle de l’inflammation, de l’infection…).
 2
2  3
3 
1- Photographie d’un matériau céramique structuré par PIM.
2- Analyses par microtomographie X confirmant une haute porosité interconnectée accessibles aux cellules (en blanc, diamètre > 40 µm).
3- Microscopie électronique montrant une cellule (ostéoblaste primaire humain) au contact d’un matériau céramique structure par PIM.
Impression 3D de matrices à partir de polymères à mémoire de forme
Responsable : Pr Halima KERDJOUDJ
FINANCEMENT : INTERREG-V France Wallonie Flandres 3D4MED
DOMAINE D’APPLICATION : Médecine Régénératrice
COLLABORATIONS : Université de Gand – Ecole Nationale Supérieure Mines-Télécom Lille Douai – Katholieke Universiteit Leuven
THEMATIQUE :
L’originalité de ce projet réside d’une part, dans la formulation de nouveaux polymères biocompatibles et d’autre part, dans la préparation d’implants prêt à l’emploi à architectures complexe et individualisés selon un procédé de fabrication additive. Ces implants seront constitués de polymères fonctionnels et biocompatibles de grade GMP avec des propriétés à mémoire de forme, minimisant le traumatisme mécanique pendant et après implantation, tout en favorisant la recolonisation cellulaire et l’intégration tissulaire.
Cet axe de recherche du laboratoire s’étend de la compréhension des mécanismes de persistance bactérienne à la mise en place de nouvelles stratégies thérapeutiques.
Les infections ostéoarticulaires (IOA) aiguës ou chroniques, souvent dues à la présence de prothèses, sont un problème majeur de santé publique. Outre la problématique de l’antibiorésistance, le pourcentage très important de rechutes (33%) est essentiellement lié à la capacité des bactéries à tolérer les antibiotiques et à échapper au système immunitaire. A cause de ces mécanismes de persistance, les IOA entraînent fréquemment des séquelles (ex. mauvaise ostéointégration inhibant la cicatrisation osseuse) irréversibles, douloureuses pour le patient ainsi qu’un coût important pour les services de santé. Il apparait donc essentiel de comprendre le fonctionnement de ces mécanismes encore mal connus dans l’environnement osseux au cours d’infections, mais aussi de mieux décrypter les communications hôte/pathogène. Développer ces connaissances permettra de proposer des stratégies anti-infectieuses innovantes (antimicrobiennes, antibiofilm et anti-internalisation) dans le but d’optimiser la prise en charge des patients.
- Lutter contre les biofilms à Staphylococcus aureus en contexte d’IOA
- Mieux comprendre les biofilms à Cutibacterium acnes dans un contexte d’IOA
- Le risque infectieux lors de pathologies impactant le liquide synovial
- Comprendre la persistance des IOA par l’étude de prélèvements biologiques (MembranOs) et du rôle de bactéries variantes
- Mieux appréhender les infections ostéo-articulaires : étude de l’interaction entre pathogène et système immunitaire inné de l’hôte
Lutter contre les biofilms à Staphylococcus aureus en contexte d’IOA (InVitrOs/BIOScreenTarget):
Responsable du projet : Dr Fany REFFUVEILLE
FINANCEMENT :
Région Grand Est – Grand Reims – Université de Reims Champagne Ardenne – ECCMID – Institut Carnot MICA – ANR
DOMAINES D’APPLICATION :
Santé humaine, infectiologie
PUBLICATIONS :
Les publications antérieures de l’équipe sur ce thème sont accessibles ici
COLLABORATIONS :
Pr REW Hancock, CMDR, University of Bristish Columbia, Vancouver, Canada
Pr Tom Coenye, Laboratory of Pharmaceutical Microbiology, Universiteit Gent, Belgium
Dr Susana Hartmann, Orthopaedic Hospital Vienna-Speising
Pr S Chevalier et O. Lesouhaitier, CBSA, Evreux, Université de Rouen, France
Pr L Voutquenne, Pr S Gérard, ICMR, UMR CNRS 7312, Université de Reims Champagne Ardenne, France
Pr S Baud, MEDyC, ‘UMR CNRS 7369, Université de Reims Champagne Ardenne, France
CHU de Reims
IREPA Laser
CRITT Matériaux Innovation
THEMATIQUE :
L’environnement osseux est spécifique par son caractère hypoxique, sa faible disponibilité en nutriments et la forte concentration en ions tels que le magnésium ou le calcium, mais aussi par les supports rigides qui le compose (os, prothèse). Tous ces paramètres influencent notamment la colonisation du support par le biofilm, un mode de vie protégeant les bactéries contre les attaques du système immunitaire et des antibiotiques, et dont les caractéristiques sont spécifiques à chaque type de bactérie. Une meilleure compréhension des biofilms à Staphylococcus aureus (BIOScreenTarget) pathogène prédominant dans les IOA, nécessite le développement de modèles in vitro (InVitrOs) ou ex vivo représentatifs de la réalité clinique. Ces modèles pourront permettre à la fois de décrypter la morphologie et la composition des biofilms ainsi que la réponse bactérienne mise en place en site osseux, mais également de développer et de tester des molécules antibiofilms contre des cibles comme les signaux inducteurs de biofilm. Plusieurs modèles sont actuellement à l’étude et seront complétés, validés et valorisées dans le futur contrat (brevet).
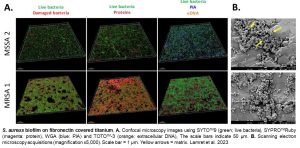
Mieux comprendre les biofilms à Cutibacterium acnes dans un contexte d’IOA (CaOs)
Responsable du projet : Dr Fany REFFUVEILLE
FINANCEMENT :
Université de Reims Champagne Ardenne – ECCMID – SFR Cap Santé – CHU de Reims – Région Grand Est
DOMAINES D’APPLICATION :
Santé humaine, infectiologie
PUBLICATIONS :
Les publications antérieures de l’équipe sur ce thème sont accessibles ici
COLLABORATIONS :
Pr S Chevalier et O. Lesouhaitier, CBSA, Evreux, Université de Rouen, France
Dr Jérôme JOSSE –CIRI – Université de Lyon, France,
Dr Julien VERDON, Université de Poitiers
CHU de Reims
THEMATIQUE :
L’os et la dent présentent une minéralisation importante mais sont néanmoins des tissus vivants constitués de différents types cellulaires avec lesquels les bactéries planctoniques peuvent interagir de façons complexes. En particulier, il a été observé que S. aureus et Cutibacterium acnes peuvent être internalisées dans les cellules osseuses telles que les ostéoblastes ou les cellules souches mésenchymateuses, leur permettant ainsi de survivre, moduler les phénomènes inflammatoires et échapper au système immunitaire. Etudier les comportements de l’ensemble des acteurs cellulaires du microenvironnement osseux, en présence de souches de C. acnes isolées de patients atteint d’une IOA sur prothèse permettra de mieux appréhender et optimiser la prise en charge de ces patients (CaOs). Des modèles in vitro (co-cultures cellules eucaryotes et bactériennes sur matériaux) et in vivo (rat, lapin) seront développés à cette fin, en lien avec les projets de l’axe 1. De plus, le mécanisme d’internalisation de la bactérie peut entraîner des modifications de son comportement, notamment en accroissant sa capacité à former des biofilms, suggérant une possible intrication des phénomènes de persistance. Ce mécanisme est essentiel à étudier. Pour cela, l’utilisation de la spectroscopie InfraRouge ou l’AFM, combinées aux méthodes plus classiques, permettront de qualifier ces modifications (ex. protéines d’adhésion de la paroi) et changements phénotypiques qui découlent très certainement du stress de l’internalisation. Là encore, mieux comprendre ces phénomènes est fondamental pour une meilleure prise en charge des patients.

Le risque infectieux lors de pathologies impactant le liquide synovial
Responsable du projet : Dr Fany REFFUVEILLE
FINANCEMENT :
CHU de Reims – ESR Champardennais –
DOMAINES D’APPLICATION :
Santé humaine, infectiologie
COLLABORATIONS :
Dr Loïs BOLKO et Pr JH Salmon, Service Rhumatologie, CHU de Reims
THEMATIQUE :
Les infections ostéoarticulaires (IOA) demeurent un enjeu de santé publique du fait de leurs incidences, leurs coûts, et leurs traitements particulièrement complexes. Ainsi, la prévention est particulièrement importante avec des facteurs de risque identifiés, comme les rhumatismes inflammatoires chroniques, sans toutefois comprendre quelles en sont les raisons. Ce type de pathologies est pourvoyeur d’arthrites et entraine des modifications du liquide synovial (LS) qui pourrait favoriser une colonisation bactérienne.
Ce projet étudie le comportement de Staphylococcus aureus, bactérie particulièrement présente dans les IOA en présence de LS issus de la pratique clinique du Service de Rhumatologie au CHU de Reims. Ces LS ont été répartis en 3 grands types de pathologies (mécanique, métabolique, inflammatoire). Les premiers résultats renforcent l’observation de biofilm sous forme d’« agrégats » flottants de différentes tailles selon les LS utilisés.

Comprendre la persistance des IOA par l’étude de prélèvements biologiques (MembranOs) et du rôle de bactéries variantes (PersistOs):
Responsable du projet : Dr Marius COLIN
DOMAINES D’APPLICATION : Santé humaine, infectiologie
COLLABORATIONS :
CHU de Reims
THEMATIQUE :
Les IOA chroniques abritent fréquemment des sous-populations bactériennes particulières appelées Small Colony Variant (SCV) présentant une tolérance accrue aux antibiotiques. Bien que les biofilms et les SCV puissent être des mécanismes de persistance étroitement liés, il y a aujourd’hui un manque crucial d’études sur ce potentiel lien et il s’avère essentiel d’analyser l’impact du mode de vie biofilm sur l’apparition de SCV et, réciproquement, la capacité des SCV à produire du biofilm. Mieux comprendre ces phénomènes est primordial pour une meilleure prise en charge des patients. Deux projets débuteront très prochainement autour de cette problématique et continueront lors de ce futur contrat.
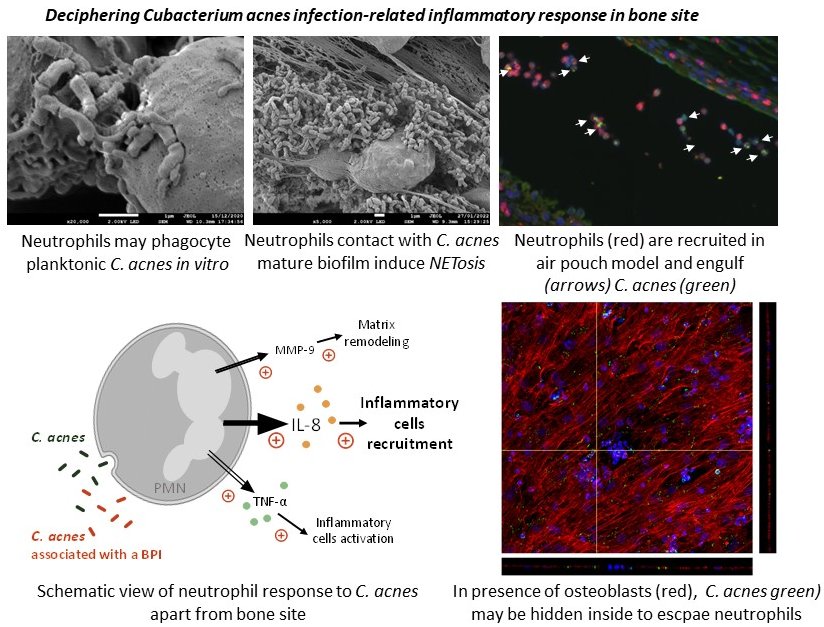
Mieux appréhender les infections ostéo-articulaires : étude de l’interaction entre pathogène et système immunitaire inné de l’hôte
Responsables du projet : Dr Frédéric VELARD – Dr Fany REFFUVEILLE – Dr Marius COLIN
FINANCEMENT :
DOMAINES D’APPLICATION :
Santé humaine, infectiologie
COLLABORATIONS :
CHU de Reims/ CIRI, INSERM U1111, Lyon – AO Research Institute Davos, Davos, Suisse
THEMATIQUE :
Cutibacterium acnes (C. acnes) est un microorganisme commensal de la peau humaine saine responsable d’infections ostéo-articulaires sur prothèse, en particulier au niveau de l’épaule. L’apparition des signes cliniques de ce type d’infection est souvent retardée avec une symptomatologie frustre complexifiant le diagnostic et la prise en charge et menant régulièrement à des infections chroniques. Cette chronicisation est également observable avec des agents pathogènes plus virulents tels que Staphylococcus aureus (S. aureus) bien que la réponse initiale de l’hôte soit franche. Dans ces cas de récidive, S. aureus présente très fréquemment un phénotype de Small Colony Variant (SCV)
L’objectif de ce travail est d’étudier le processus inflammatoire, et notamment la réponse des cellules immunitaires (PNN, macrophages, ostéoclastes…), induit par des souches cliniques de C. acnes et S. aureus, en prenant soin de dissocier les souches sauvages des SCV. Un modèle original de culture tripartite (cellules osseuses, immunitaires et bactéries) sur matériau prothétique, mimétique d’une infection en site osseux a récemment été mis en place in vitro au sein du laboratoire et permet ainsi d’étudier à la fois la réponse du système immunitaire à la présence de bactéries mais aussi d’étudier leur réponse dans un environnement inflammatoire proche de la complexité du site osseux.
Les approches déployées au sein de cette thématique visent à
- Comprendre la spécificié de réponse de C. acnes vs le système immunitaire
- Evaluer l’impact du SCV sur la réponse inflammatoire
- Déchiffrer l’importance de la pression exercée par les cellules de l’hôtes sur la réponse des bactéries et notamment sur l’engagement du programme biofilm, la formation de SCV ou encore leur capacités d’internalisation
- Mettre au point d’un modèle in vivo d’infection ostéoarticulaire sur matériel afin d’étudier l’inflammation au niveau de l’environnement osseux et parallèlement au niveau systémique.
L’ensemble des résultats de ces travaux devrait fournir des éléments de compréhension quant à l’interaction entre les cellules de l’hôte et les pathogènes au cours d’une infection ostéo-articulaire afin de mieux les prévenir ou lutter contre plus efficacement.
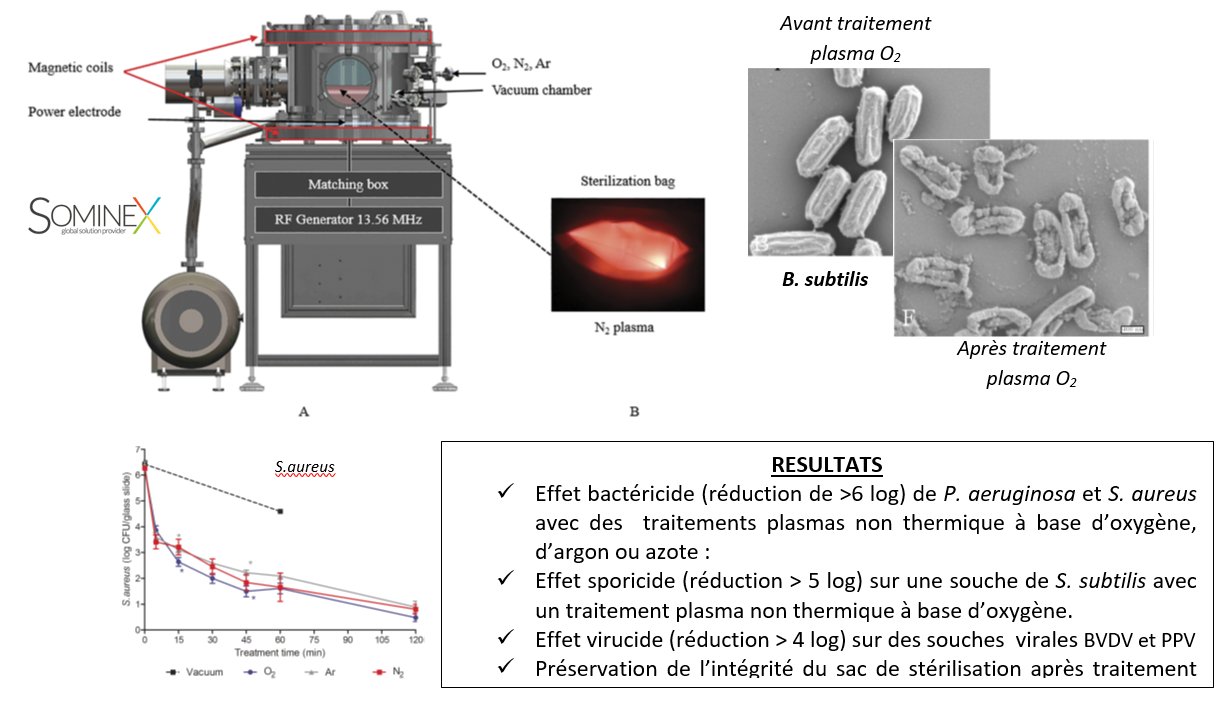
Innovative non-thermal plasma disinfection process inside sealed bags: Effectiveness in regard to current sterilization norms (PLAS’STER)
Responsable : Pr. MP. Gellé
(Tél : +33 3.26.91.86.41 Email : [email protected])
FINANCEMENT : Projets Emergence Région Champagne-Ardenne; ANR ; DGA
DOMAINES D’APPLICATION : Milieu médical, pharmacologie, aérospatial
PUBLICATIONS : – BenBelgacem Z, et al. IRBM. 2016;37:68–74.
– BenBelgacem Z, et al. PLoS ONE. 2017;12(6): e0180183.
BREVET : WO 2012/038669 A1. JM Popot et MP Gellé
COLLABORATION : CRITT-MDTS (Charleville – Mézières), Sominex (Bayeux), UMR7344 GREMI
OBJECTIF :
Mise au point d’un prototype permettant de stériliser par plasmas non thermiques des dispositifs médicaux pré-conditionnés dans un sac de stérilisation. Cette technique de stérilisation est dédiée aux dispositifs ne supportant pas des méthodes de stérilisation conventionnelles telle que la gammagraphie, la chaleur humide (autoclave) et l’oxyde éthylène.
Articulateur pour prothèse en odontologie pédiatrique. Mise au point d’un prototype d’articulateur modulable
utilisable du jeune enfant à l’adulte.
Responsable : Pr. MP. Gellé
(Tél : +33 3.26.91.86.41 Email : [email protected])
FINANCEMENT : Fondation Groupama
DOMAINES D’APPLICATION : Odontologie. Prise en charge de patients par exemple atteints de maladies génétiques ou ayant subi un traumatisme dentaire et nécessitant une réhabilitation prothétique.
COLLABORATION : Laboratoire EA 4691 « BIOS «, CHU-Reims-Unité d’aide méthodologique, CHU Reims – Pôle odontologique et lycée Saint Jean-Baptiste de la Salle.
OBJECTIF : Mise au point d’un prototype d’articulateur modulable utilisable chez le jeune patient, depuis la petite enfance jusqu’à l’âge adulte.
CONTEXTE MEDICAL :
Dans le domaine odontologique, l’utilisation d’un articulateur permet de réaliser une analyse occlusale à des fins pré-prothétiques, pré-orthodontiques ou dans le cadre d’une dysfonction de l’appareil manducateur (D.A.M.). Dans un but thérapeutique, il permet lors de la réalisation de prothèses dentaires, une meilleure communication entre le chirurgien-dentiste et le prothésiste, une simulation de la situation occlusale souhaitée, tout en travaillant en l’absence du patient.
En effet, pendant des décennies, les jeunes patients atteints de maladies génétiques ayant une répercussion sur le développement maxillo-facial et dentaire ont été les « parents pauvres » dans le domaine de la chirurgie-dentaire. Depuis une dizaine d’année, des enfants, dès l’âge de 3 ans, sont pris en charge au sein des centres hospitaliers universitaires. Cependant, la réalisation de prothèses dentaires s’avère difficile et compliquée du fait qu’aucun articulateur ou arc facial n’est adapté aux enfants. Idéalement, la création d’un articulateur modulable capable de s’adapter à la croissance de l’enfant permettrait de lever un certain nombre de verrous diagnostiques, thérapeutiques et techniques.
Ce projet se divise en plusieurs étapes :
- Etude épidémiologique et statistique.
Cette étude se propose d’étudier les différents points anatomiques nécessaires à la réalisation d’un articulateur (Art), d’un arc facial (AF), d’une table de montage (TM)) et d’une fourchette (F). Elle est actuellement menée au sein du Pôle Odontologie du CHU de Reims. L’inclusion des patients est réalisée au cours des consultations dans les services d’Odontologie Pédiatrique (OP) et d’Orthopédie Dento-Faciale (ODF). Trois classes d’âges ont été sélectionnées : 3 à < 6 ans ; 6 à < 9 ans et 9 à 12 ans.>/p>
Etude de faisabilité de la réalisation d’un prototype
par impression tridimensionnelle (3D) a été effectuée dans le cadre du lycée Saint Jean-Baptiste de la Salle.
Impression 3D du prototype
sera réalisée avec le groupe de travail du lycée Saint Jean-Baptiste de la Salle après analyse statistique de l’étude épidémiologique.
Comparaison du prototype
avec un articulateur classique lors de la prise en charge de patients dans le cadre du Pôle Odontologie du CHU de Reims.
